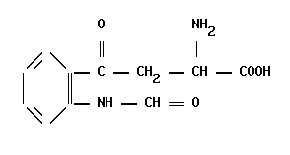
Функции транспортных белков
Ангаотензинсвязывающий белок
Ангаотензинсвязывающий белок, возможно, появляется в крови при патологии и идентичен митохондриальной олигопептидазе М; белок, связывающий адреномедуллин, является фактором Н комплемента; кортиколиберинсвязьшающий белок образует собственное семейство; соматотропин и пролактинсвязывающие белки — протеолитически отщеплённые или модифицированные альтернативным сплайсингом внеклеточные домены соответствующих Рц; белки, связывающие цитокиньї ИЛ-2, ИЛ-6, цилиарный нейротрофический фактор, являются растворимыми СЕ соответствующих Рц, а остеопротегерин — ложным Рц или Рц-манком; утероглобин, простатеин относятся к семейству утероглобинов, или секретоглобинов; фоллистатин и родственные белки составляют собственное семейство.
Большинство транспортных белков, находящихся в крови, синтезируется в печени. Вместе с тем, те же белки могут продуцироваться локально (в частности, в тканях-мишенях соответствующих лигандов).
Функции транспортных белков разнообразны и включают эффекты, как связанные, так и не связанные с их лигандами.
В многочисленных экспериментах с манипулированием уровнем транспортных белков показано, что эти белки способны снижать скорость метаболического клиренса своих лигандов и ингибировать их биологическое действие. Ясно, что данный тормозный эффект должен проявлять себя только в переходных условиях, т.е. при изменениях продукции/деградации сигнальных соединений или самих транспортных белков. В стационарных же условиях системы рецепции и метаболизма сигнальных соединений адаптированы к имеющемуся уровню свободного лиганда. Можно полагать, что переходные условия чаще возникают при резком повышении содержания сигнальных соединений (например, при стрессорной реакции, родах, предовуляторном выбросе эстрогенов). При этом соответствующие транспортные белки становятся фактором амплификации гормонального сигнала в силу ограниченной ёмкости транспортных белков.
Транспортные белки
Транспортные белки (например, тироксинсвязывающий глобулин, транскальциферин, кортиколиберинсвязывающий белок) могут экспрессироваться на уровне, значительно превышающем продукцию соответствующего гормонального лиганда, в результате чего создается значительный «резерв» сигнального соединения (в форме комплексов с транспортным белком), который может быть использован при недостаточном поступлении сигнального соединения. В данной ситуации транспортный белок выполняет буфер-но-резервирующую функцию.
Транспортные белки способны выполнять функцию направленного транспорта сигнальных соединений посредством по меньшей мере двух механизмов:
а) высвобождения лиганда в тканях с усиленной деградацией транспортного белка, происходящей преимущественно благодаря протеолизу, или в условиях изменений конформапии транспортного белка, ведущих к снижению его сродства к лиганду (фосфорилирование, взаимодействие с компонентами внеклеточного матрикса или клеточной поверхностью); примером действия такого механизма может служить аутостимуляция роста опухолей за счёт локального высвобождения ИФР при разрушении их связывающих белков; б) связывания транспортных белков соответствующими Рц на поверхности клеток-мишеней; в результате локальная концентрация сигнального соединения может возрастать; данный механизм, кроме того, может обеспечивать путь поступления сигнальных соединений внутрь клетки в результате интернализации тройного комплекса «лиганд/транспортный белок/Рц транспортного белка» (например, поступление ИФР в ядро пролиферирующих клеток).
Транспортные белки могут выполнять собственные сигнальные функции, а транспортируемые ими лиганды могут играть роль аллостерических регуляторов. Например, сексстероидсвязывающий глобулин, транскортин, тироксинсвязывающий глобулин способны влиять на обменные процессы через собственные Рц, а соответствующие гормональные лиганды могут модулировать эти эффекты (так, сексстероидсвязывающий глобулин, действуя на передний гипоталамус, стимулирует женское половое поведение, а комплекс белка с 5ос-дигидротестостероном — нет).
Белки, связывающие инсулиноподобные факторы роста
В ряде случаев транспортные белки способны взаимодействовать с другими внеклеточными белками и оказывать влияние на их активность. Так, значительная часть транстиретина крови находится в комплексе с другим транспортным белком — ретинолсвязывающим белком, что обеспечивает предотвращение клубочковой фильтрации и экскрецию последнего.
В качестве иллюстрации структуры и функций транспортных белков далее рассмотрено семейство белков, связывающих инсулиноподобные факторы роста (ИФР), и родственных им белков.
Надсемейство белков, связывающих инсулиноподобные факторы роста (ИФРСБ, IGFBPs), включает 6 ИФРСБ (ИФРСБ- 1-ИФРСБ-6), обладающих высоким сродством (Kd ~0,1 нМ) к инсулиноподобным факторам роста (ИФР-І и ИФР-П), и 9 белков, родственных ИФРСБ (ИФРСБ-рБ1-ИФРСБ-рБ9, IGFBP-rPl-IGFBP-rP9), обладающих низким сродством (Kd >10 нМ) к ИФР. Для белков надсемейства характерно высокое содержание консервативных остатков цистеина, которые в ИФРСБ локализованы в N- и С-концевых доменах, разделенных вариабельной областью. В ИФРСБ-рБ N-концевой домен сходен с таковым в ИФРСБ, а другие области молекулы имеют существенные отличия. Предполагается, что остатки цистеина N- и С-концевых доменов ИФРСБ за счёт образования внутридоменных дисульфидных связей формируют строго упорядоченную глобулярную структуру белка. Средний домен большинства ИФРСБ гликозилирован (возможная функция — придание устойчивости к протеолизу), может быть фосфорилирован по остаткам серина (возможные функции — модуляция взаимодействия с кислотолабильной СЕ ИФРСБ и клеточной поверхностью) и служит шарниром между N- и С-концевыми доменами. С-концевой домен (вместе с N-концевым доменом) участвует в формировании кармана для связывания ИФР, а также обеспечивает взаимодействие ИФРСБ с другими молекулами. Такими молекулами могут быть кислотолабильная СЕ ИФРСБ (для ИФРСБ-3 и ИФРСБ-5); интегрины, обеспечивающие связь с внеклеточным матриксом (для ИФРСБ-1 и ИФРСБ-2); протеогликаны клеточной поверхности и внеклеточного матрикса (для ИФРСБ-3, 5 и 6); белки, обеспечивающие транслокацию в ядро активно пролиферирующих клеток (для ИФРСБ-3 и ИФРСБ-5).
Доменная организация белков
Активность ИФРСБ может регулироваться их протеолизом, фосфорилированием, взаимодействием с поверхностью клеток или внеклеточным матриксом. Так, связывание ИФР с ИФРСБ-4 повышает доступность ИФРСБ-4 для протеазы. Фосфорилирование ИФРСБ при их биосинтезе в некоторых тканях также может влиять на их активность: сродство фосфорилированного ИФРСБ-1 к ИФР в 6 раз выше, чем сродство нефосфорилированного белка. Связывание некоторых ИФРСБ (конкретно, ИФРСБ-3 и ИФРСБ-5) с клеточной поверхностью или с внеклеточным матриксом многократно снижает их сродство к ИФР.
Экспрессия ИФРСБ осуществляется многими тканями и находится под контролем множества гормональных и паракринных факторов, набор которых для конкретной ткани может быть индивидуальным.
В крови преобладающая часть ИФР (-75%) находится в виде крупных (-150-200 кДа) комплексов, включающих ИФРСБ-3 и кислото-лабильную СЕ ИФРСБ. Такой комплекс не способен проходить через эндотелиальный барьер, что обеспечивает создание резервуара ИФР с длительным периодом полужизни (15—20 ч). Приблизительно 20-25% ИФР находится в виде менее крупных (-40-50 кДа) комплексов с другими ИФРСБ, и такие комплексы способны проходить через эндотелий сосудов и формируют пул биологически доступного для тканей ИФР (период полужизни -30 мин). Свободный ИФР составляет менее 1% от его общего содержания в крови (период полужизни -10 мин). Соответственно, нокаут гена als кислотолабиль-ной СЕ ИФРСБ у мыши приводит к снижению уровня ИФР в крови на 80%. Комплексы ИФР с различными ИФРСБ обнаруживаются во многих других биологических жидкостях, причём соотношение разных ИФРСБ в данной жидкости может существенно отличаться от наблюдаемого в крови. Например, в амниотической жидкости преобладает ИФРСБ-1, в цереброспинальной жидкости — ИФРСБ-2 и ИФРСБ-6, в матриксе кости — ИФРСБ-5.
- Предыдущие статьи из рубрики: Эндокринология